介绍
在人类肾小球疾病中,慢性蛋白尿可能通过几种不同的介质导致近端肾小管损伤。其中,尿中内皮素-1(ET-1)的排泄(最初被描述为有效的血管收缩肽[1])被发现与人类肾脏疾病的严重程度相关[2-5]因此,有几项但并非所有的内皮素抑制剂研究都能够通过减缓肾脏疾病进展来证明有益的抑制作用[6-10]。
ET-1介导的信号转导发生通过一种涉及二聚体转录因子的多效性核因子κB(NF-κB)家族的炎症信号转导级联[11]。最近,我们发现有丝分裂原激活蛋白激酶p38α(MAPK p38α)[12]和蛋白激酶Cα(PKCα)[13]在ET-1刺激后与NF-κB p65结合形成功能性转录复合物(TC)。作为TC的一部分进行核转运后,PKCα能够通过直接分子相互作用抑制静息细胞中pri-miRNA15a的释放[13]。
microRNA(miRNAs)是一种短的非编码RNA,通过靶向蛋白质编码转录物的mRNA序列,在细胞功能和发育中发挥重要作用,导致mRNA切割或抑制细胞质中的生产性翻译。在细胞核中,存在两种不同形式的未成熟miRNA(pre-和pri-miRNA),从中衍生出最终、成熟和功能性miRNA形式[14]。在miRNA15a的情况下,ET-1刺激导致核PKCα水平降低。这导致成熟miRNA15a产量增加,并在上清液中释放[13]。到目前为止,这种信号已经被描述为Caki-1细胞,近端小管细胞的恶性变体[13]。由于在肾癌患者的尿液中检测到miRNA 15a水平上调,该miRNA被认为是透明细胞肾细胞癌的新标记物,代表了大多数恶性肾肿瘤[15]。
了解到尿ET-1水平在蛋白尿疾病中上调,以及了解ET-1诱导miRNA15a释放的调控途径,我们假设本研究可能产生三个病理生理学相关的结果,并用于诊断的重要问题:i)尿液中miRNA15a的排泄作为与蛋白质或ET-1水平或两者相关的蛋白尿的一般标记;ii) miRNA15a作为肾小球疾病的指标,有助于区分长期的、免疫复合物介导的肾小球基底膜损伤(如膜性肾病)与复发的、短暂的和“自愈”疾病(如微小改变肾病),iii)作为一种特定途径(在这种情况下炎症NF-κB)的尿液生物标志物,无论持续的介质刺激导致蛋白尿,它都可以作为治疗靶向。最后一个问题与家族性肾病综合征(如先天性芬兰肾病、弥漫性系膜硬化症、Alport综合征)尤其相关,在家族性肾病综合征中,潜在的遗传改变导致慢性蛋白尿和最终的肾衰竭,这是相当难以治疗的。在这些情况下,检测主要炎症通路的激活(通过miRNA15a),可能通过靶向特定蛋白(如PKCα)来影响它,此外能够监测治疗的效果(通过减少尿液中的生物标志物miRNA15a)可能是一个理想的临床目标。
材料和方法
材料
人类肾脏活检经福尔马林固定、石蜡切片,取自德国科隆大学医院病理科档案。5例均有微小变化,5例特发性膜性肾病和5例新移植肾(所谓的空活检)(表1a-1e)。根据表1所示的诊断,从患者和健康对照组中选择大约50 - 100毫升的尿液样本。收集24小时的尿液,并在-20°C下冷冻样本直到进一步使用。在选定的患者中,平行收集约1ml的血清样本。由于对人体材料(血清、肾组织、尿液)进行了调查,因此按照1975年《赫尔辛基宣言》(1983年修订)或《伊斯坦布尔宣言》(移植活组织检查)中制定的伦理标准,分别对程序进行了概述,经科隆大学医院伦理委员会事先批准(德国科隆;参考号:09 - 232)。获得每位患者或患儿家长的知情同意。除非另有说明,所有试剂均购自Sigma-Aldrich(德国慕尼黑)。
成年雄性BALB/c小鼠取自Charles River (Erkrath,德国)。所有动物实验均按照《实验室动物护理和使用指南》(美国国家卫生研究所,Bethesda, MD)进行,并获得卫生部批准(小鼠:84-德赢vwin首页网址02.04.2012.A118)。人们尽一切努力将被使用的动物数量和它们的痛苦降到最低。
方法
疾病的动物模型:在小鼠蛋白尿阿霉素模型中,每只雄性BALB/c小鼠(体重20 g;8周龄;查尔斯河)[16]。水和食物是随意供应的。实验分为四组,每组10只动物,尾静脉注射量相同:生理盐水或司来吉兰注射的对照组小鼠,阿霉素注射的小鼠,以及阿霉素注射的小鼠,在第3周同时腹腔注射司来吉兰,连续7天。司来吉林按体重10 mg/kg加入生理盐水[17]。第3周末处死动物。肾脏经磷酸盐缓冲盐水固定和石蜡包埋处理。对he和e切片进行光镜评价。心脏穿刺收集24小时尿、血清。
细胞培养:原代人肾近端上皮小管细胞(RPTEC)购自Pelobiotech (CC-2553) (Planegg, Germany),并根据制造商说明书使用REBM(肾上皮细胞基础培养基,不含生长因子,CC-3191)加上REGM SingleQuots (CC-4127)在37℃和5% CO下进行培养2.
MDCK细胞(Madin Darby犬肾细胞)购自Sigma-Aldrich(84121903-1VL,德国慕尼黑),并根据制造商的说明使用UltraMDCK无血清培养基(12-749Q,瑞士巴塞尔Lonza)进行培养。采用第6~7代细胞。对于所有实验,细胞在无血清培养基中预培养24小时。
如最近所述,通过转染温度敏感的SV40 T基因开发了条件永生化人足细胞细胞系[18].细胞在33°C下增殖,并在转移到37°C后转化为静止、分化的表型。培养基含有标准RPMI,提供10%胎牛血清(德国柏林Biochrom)和胰岛素转铁蛋白亚硒酸钠补充剂(德国卡尔斯鲁厄Gibco).对于实验,仅在37°C下培养至少14天后使用细胞,直到通过树状形态可见其分化。
所有细胞系生长至80-90%汇合,并用不同介质处理24小时:内皮素-1(50nm)[12,13];转铁蛋白(10mg/ml)[19];人白蛋白(5mg/ml)[20];TNFα(10ng/ml)[21];血管紧张素(10-7米)[22];患者尿液(1:10稀释);或新鲜分离的补体(稀释1:10;JWUF捐赠)[23]作为对照,RPTEC和MDCK细胞在没有FCS的情况下生长24小时。Selegiline的浓度为1µmol[24]。尿液标本经过过滤(0.2µm注射器尖过滤器),常规采用巴氏染色和帕本海姆染色的细胞学方法分析具有代表性的样本的细胞和感染迹象。
人体活检:使用来自德国科恩科恩大学医院病理科档案的福尔马林固定和石蜡化的人类肾组织样本。
组织学评估是基于工作人员病理学家(JWUF)的分析,使用常规光镜分析(苏木精-伊红,周期性酸希夫,弹性van Gieson)和免疫组织学染色(IgG, IgG4, IgA, IgM, C1q, C3,纤维蛋白原)石蜡切片。
小鼠肾小球和小管的分离:新鲜获取的肾脏被切割成冠状动脉切片。皮质和髓质分离。这两种都被单独切碎并通过分级筛分进行传代[25]。用收集的PBS和组织样本冲洗筛子数次。样本在细胞培养显微镜下进行分析。获得99%的纯肾小球分数。样品在-70°C下冷冻,直到进一步使用。
激光显微解剖人类肾脏活检:每个病例切下常规福尔马林固定、石蜡化、存档的人体活检标本的两个7µm厚切片,并放置在涂层玻片上;每个病例使用30个肾小球切片。脱蜡后,用氩激光对肾小球进行显微解剖,并在捕获装置中弹射[26]。将剩余的皮质组织从载玻片上刮下并全部使用。使用miRNA分离试剂盒对来自Qiagen的FFPE样品进行进一步制备。作为对照,使用肾移植时移植患者的活组织检查(“空”活组织检查)。
FFPE样品中miRNA的分离:对于FFPE样本的miRNA分离,根据制造商的方案使用Qiagen的miRNeasy FFPE试剂盒[15]。RNA定量是使用纳米滴技术完成的[15]。
从尿液中分离miRNA:从患者尿液中分离miRNa,使用1ml尿液加入Qiazol试剂混合,并根据制造商的方案(miRNeasy Mini kit, Qiagen)[15]使用。RNA定量使用NanoDrop技术[15]完成。
定量实时PCR(qRT PCR):取上述cDNA的1µl进行实时PCR分析。实验设置如前所述[12,13]。定量分析,测定β-肌动蛋白。所有样品均归一化为β -actin作为内参基因。所有实验都是三次重复。如用户公报2 (PE Applied Biosystems)[12,13]所述,使用ΔΔCT方法计算相对荧光。采用Student 's unpaired t-检验评估qRTPCR值在不同时间点的统计学意义。
根据制造商的说明使用miRNA15a的mirVana qRT PCR引物组。5s rRNA的引物组用于使不同样本之间的结果正常化[15]。
RT-PCR:根据制造商的方案,使用随机引物和NCode VILO miRNA cDNA合成试剂盒(Invitrogen)从250 ng RNA中获得cDNA。如前所述进行RT-PCR[12,13]。
统计数据
所有实验均为3个重复。统计分析使用GraphPrism 5程序。采用方差分析(ANOVA),用Newman-Keuls方法计算显著差异,并用星号表示(* p<0.05, **p<0.01, ***p<0.001)。无指征的差异均无统计学意义。
我们分析了注射阿霉素或假手术的两组动物的体重和尿蛋白排泄值,然后使用双尾Student t检验将它们随机分为生理盐水或selegeline治疗组。
否则报告的值是组平均值+/-整个文章的标准偏差。所有涉及人类尿液或组织分析的结果(图1-4)都进行了box - blot评估,以显示数据中的分散程度(扩散)和偏斜度。
后果
1.微量改变(MCN)成人患者、特发性膜性肾病(MN)和心功能不全导致的急性肾功能衰竭(ARF)成人患者的尿液中miRNA的定量
在所有24小时内,qRT PCR检测到微小变化或膜性肾病成人的尿液中miRNA 15a含量较高,范围在200到600个相对荧光单位之间(图1)。相反,心脏前肾功能不全引起的急性肾功能衰竭患者的尿液中miRNA水平低100到300倍(图1).在儿科患者中,微小病变肾病中可检测到高miRNA15a值(图1)。血清miRNA15a水平至少比尿液水平低300倍(数据未显示)。

图1:微量改变(MCN)成人患者、特发性膜性肾病(MN)和心功能不全导致的急性肾功能衰竭(ARF)成人患者的尿液中miRNA的定量
A)在A组中,MN和MCD患者尿液中miRNA15a高度表达的平均阳性/阴性STD。MCN的相对荧光水平在200到400之间,MN的相对荧光水平在500到700之间。ARF的水平没有达到相对荧光值1。用健康对照组的尿液计算相对荧光(表1d);* * * p < 0.001。
B)在B盒图中,A的数据显示,在蛋白尿疾病中,MN的最低值为400 RFUs, MCD的最低值为200 RFUs。
| 患者ID |
诊断 |
年龄(年) |
性 |
肌酐(mg/dl) |
普罗特。/克雷亚(mg / dl) |
| 1.GTU 1 |
锰 |
75 |
米 |
2, 07年 |
1063 |
| 2.GTU 18 |
锰 |
72 |
米 |
1,94 |
563 |
| 3.GTU 26 |
锰 |
52 |
米 |
1, 02年 |
15614 |
| 4.GTU 32 |
锰 |
50 |
米 |
1、12 |
489 |
| 5.GTU 45 |
锰 |
65 |
米 |
2, 36 |
2337 |
| 6.GTU 9 |
m cn |
34 |
米 |
2, 08年 |
2566 |
| 7.GTU 5 |
m cn |
35 |
F |
0, 89 |
28 |
| 8.GTU 27 |
m cn |
40 |
F |
0, 69 |
1350 |
| 9.GTU 17 |
m cn |
62 |
米 |
1, 60 |
12065 |
表1a:成年患者的数据肾小球疾病的数据来自于同时常规进行的人类肾活检组织切片,我们用于激光显微解剖分析。
2.上清液和细胞提取物中不同介质刺激24小时后培养的肾细胞系中MiRNA15a的表达
A.人足细胞
在细胞培养中,分析不同介质刺激的永生化人足细胞的上清液与细胞提取物中的miRNA15a(图2A)。然而,来自膜性肾病患者的10倍稀释尿液仅显示出相对较小的miRNA释放,即使结果乘以其稀释因子10。ET-1刺激也导致相对较小的miRNA15a释放;所有其他介质在上清液和细胞提取物中都显示出可忽略的miRNA15a表达水平。细胞提取物和上清液中miRNA15a的数量没有统计学上的显著差异,除非白蛋白刺激:足细胞在上清中释放了大量的miRNA15a,通过qRT-PCR检测,仅在完整培养的细胞中保留了少量的miRNA15a。

图2:从上清液和细胞提取物中提取不同介质刺激24小时后培养的肾细胞系的MiRNA15a表达-所有细胞系用显示的试剂刺激24小时;根据文献中确定的浓度进行选择(见方法部分)。收集上清液(黑色柱)和细胞提取物(白色柱),通过qRT-PCR分析miRNA15a。* p < 0.001。
A) 人足细胞:白蛋白刺激后上清液中miRNA15a的最大释放量。
B) 人RPTECs:ET-1导致上清液中miRNA5a的最大释放。
C) MDCK细胞:miRNA15a仅能检测到少量,细胞提取物中miRNA15a的值略高于上清(转铁蛋白除外)。
B.人类生殖细胞
在细胞培养中,对不同介质刺激的RPTEC上清液与细胞提取物进行miRNA15a分析(图2B).ET-1的刺激最有效,超过90%的miRNA15a被释放。在上清液和细胞提取物(尤其是白蛋白)中,其他介质的作用小于ET-1的10%。与人类足细胞相比,膜性肾病患者的尿液起着更重要的作用考虑稀释因子,最终结果将比单独使用ET-1的刺激高出约66%,因此,除了白蛋白外,似乎还有几种不同的介质共同作用导致这一结果。
c . MDCK细胞
在细胞培养中,分析不同介质刺激的MDCK上清液与细胞提取物中的miRNA15a(图2C)。除ET-1刺激外,细胞系和上清液中所有介质的总水平均为1.5 RFU或更低。与RPTECs相比,细胞和上清液中miRNA15a的数量显著更低,后者的值更低(转铁蛋白除外)。
3.使用selegeline的实验性治疗干预
A. MiRNA15a在培养的人rptec上清中的表达
由于司来吉兰可诱导PKCα,所以ET-1刺激后用司来吉兰预处理rptec。与et -1刺激的细胞相比,上清中MiRNA15的水平显著降低,约为350倍(图3A)。以白蛋白为刺激剂,selegiline处理可使上清中miRNA15a的表达减少约50%。
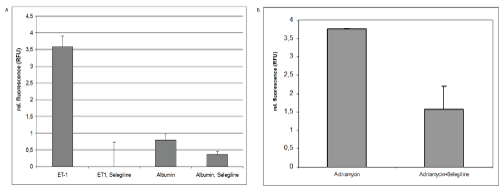
图3:使用selegeline的实验性治疗干预
(A)用ET-1处理24小时后,培养的人RPTEC上清液中的MiRNA15a表达,与未处理的对照组相比,人近端小管细胞上清液中的MiRNA15a数量增加。这种miRNA诱导可通过同时用司来吉林处理完全逆转;***p<0.001。用人albu处理24小时后至少,在上清液中可以检测到少量的miRNA5a,经司来吉林处理后,其减少到50%;*p<0.5。
B)阿霉素诱导蛋白尿中尿miRNA 15a表达的结果-文献报道阿霉素单尾静脉注射引起经典肾病[16],肾小球损伤导致蛋白尿在第3周平均为180mg /d。尿液qRT-PCR分析miRNA15a水平明显高于生理盐水注射对照组(通过rell .荧光计算)。阿霉素注射后第3周给予司来吉兰(10 mg/kg体重连续7天)治疗的动物平均相对荧光值仅为1.8,而未给予阿霉素治疗的动物相对荧光值为3.8;*与单独阿霉素治疗相比,p<0.05。
B.阿霉素诱导蛋白尿中尿miRNA15a表达的结果
在第3周结束时,阿霉素治疗的小鼠均为蛋白尿(180+23 mg),与治疗无关。对照组动物(生理盐水)未检测到蛋白尿。在阿霉素治疗的动物中,尿液中miRNA15a的水平达到4个相对荧光单位(图3B,左柱)。在阿霉素小鼠血清中未检测到miRNA15a的增加(数据未显示)。
形态学上,阿霉素治疗的动物显示单独扩张的小管和蛋白铸型。蛋白质重吸收增加(数据未显示)。
随机选择接受阿霉素治疗的小鼠进行司来吉兰治疗,司来吉兰/阿霉素治疗组和仅接受阿霉素治疗组的蛋白尿水平相匹配。仅接受司来吉兰治疗的对照动物既没有蛋白尿,也没有任何组织学损伤(数据未显示).与仅接受阿霉素治疗的动物(图3B,左栏)相比,在塞来吉兰治疗后,miRNA15a的水平降低了60%(图3B,右栏)。然而,蛋白尿的水平不受塞来吉兰治疗的影响(数据未显示)使用尿液中的miRNA15a水平作为近端小管/足细胞中炎症NF-κB途径活性的指标,selegiline降低其水平表明,该途径在这些细胞中可以下调,而蛋白尿和ET-1等典型介质仍然存在。因此,如果蛋白尿不能完全缓解如miRNA15a水平下调所示,其通过NF-κB作为促炎症介质对近端小管/足细胞的作用仍可能被阻断。
4.使用福尔马林固定、石蜡化肾小球和皮质肾小管部分进行激光显微切割分析,以定量测定miRNA
A.成人特发性MN患者与常规移植活检对照病例
对于来自膜性肾病、微小病变疾病(表1a和1b)或对照组的激光显微切割人肾活检(“空”活检,表1e)对10个肾小球切片进行显微解剖。从获得的皮质组织中分别提取miRNA,并通过qRT PCR进行分析。肾小管部分的miRNA值明显高于肾小球部分(图4A)。

图4:激光显微解剖分析用于定量miRNA使用福尔马林固定,石蜡化的肾小球和皮质小管部分
A)成年特发性MN患者与常规移植活检的对照病例——用于激光显微解剖的膜性肾病和微小病变的人类肾脏活检(表1a和1b)或对照(“无”活检,表1e)。显微解剖10片肾小球切片。从获得的皮层组织中分别提取miRNA并进行qRT-PCT分析。肾小管部分的miRNA值明显高于肾小球部分(图4A)。使用的对照病例列于表1e。MN膜性肾病;MCH微小改变病;* p < 0.05。
B) 对患有阿霉素肾病的小鼠进行分级筛选3周和单剂量阿霉素12周后的肾小球和肾小管中的MiRNA15a表达分析。在这两个时间点,近端肾小管中的MiRNA15a含量显著高于激光切割肾小球;*p˂0.05。
| 病人# |
诊断 |
年龄(年) |
性 |
蛋白尿(g/24小时) |
| 1. |
m cn |
6 |
米 |
5 |
| 2. |
m cn |
4 |
米 |
3,64 |
| 3. |
m cn |
14 |
F |
4 |
| 4. |
m cn |
3. |
米 |
11,16 |
| 5. |
m cn |
9 |
米 |
8,5 |
表1 b:来自患有微小病变肾病(MCN)的儿童患者的数据——每位患者的肌酐(低于0.9 mg/dl)和尿素(低于45 mg/dl)水平均在正常范围内。
| 病人ID |
诊断 |
年龄(年) |
性 |
肌酸酐(毫克/分升) |
少尿(毫升/小时) |
相似的
阶段 |
| 1 |
旁路Op,HD |
78 |
F |
-- |
20 |
1 |
| 2 |
心脏不适 |
55 |
米 |
1,0 |
-- |
3. |
| 3. |
恩斯特米,
败血症 |
78 |
米 |
0,8 |
? |
2 |
| 4 |
肾前型急性肾衰 |
74 |
米 |
0、7 |
20 |
1 |
| 5 |
肾前型急性肾衰 |
57 |
米 |
0、9 |
20 |
1 |
| 6 |
高清 |
89 |
米 |
1,0 |
20 |
3. |
| 7 |
冠心病,ACVB |
73 |
米 |
0、9 |
20 |
2 |
| 8 |
CI,脑死亡 |
42 |
米 |
1,1 |
30 |
3. |
表1 c:成人急性肾功能衰竭患者根据急性肾损伤(AKIN)分类[27];HD:血液透析;ARF:急性肾功能衰竭;CHD:慢性心脏病;ACVB:急性冠状静脉搭桥术;CI:心功能不全。
| 控制ID |
年龄(年) |
性 |
| 锰 |
24 |
F |
| 不 |
28 |
F |
| 可 |
30 |
米 |
| SK |
29 |
米 |
| 勒 |
64 |
米 |
| VD |
66 |
米 |
表1 d:成年人作为健康控制。
| 病人# |
诊断 |
年龄(年) |
性 |
| 1 |
NTX |
44 |
米 |
| 2 |
NTX |
68 |
米 |
| 3. |
NTX |
36 |
米 |
| 4 |
NTX |
39 |
米 |
| 5 |
NTX |
60 |
米 |
表1 e:来自作为激光显微切割对照肾组织的“空”活检患者的数据。
B.阿霉素肾病小鼠
使用肾皮质切片进行分级筛选,将肾小球与肾小管分离。通过qRT PCR,注射阿霉素后3周,近端小管中发现的miRNA15a水平约为肾小球的4倍,12周时约为肾小球的3倍(图4B)。未经处理的对照同窝小鼠的肾小球和肾小管部分用于计算相对荧光。
讨论
我们开始这项研究,利用miRNA15a作为蛋白尿疾病的机制特异性标志物,分析炎症NF-κB通路的诊断作用。从结果来看,我们假设miRNA15a主要在蛋白尿中上调,这对于监测靶向治疗后其减少很重要;ii)它也被ET-1激活,是蛋白尿疾病的主要介质之一。然而,在蛋白尿患者的尿液中检测到它并不能区分与蛋白尿相关的著名肾小球疾病(如MN vs. MCN)。此外,由于炎症通路的激活同样发生在足细胞和近端小管中,分析尿液miRNa15a水平不能确定不同细胞类型的个体贡献。
相反,miRNA15a可以作为炎症NF-κB通路的一种特异性尿生物标志物,监测靶向PKCα的作用,而不管持续的介质刺激导致蛋白尿。因此,在慢性蛋白尿疾病如家族性肾病综合征(即先天性芬兰肾病、弥漫性系膜硬化、Alport综合征)中,NF-κB炎症信号活性的检测和治疗监测可能是一种新的诊断工具。潜在的基因改变导致有效治疗的问题。为此目的,预先描述潜在的信号级联是至关重要的[12,13]。
我们提出了一种新的策略,利用miRNAs作为近端小管损伤的生物标志物,肾小球疾病伴蛋白尿和尿内皮素-1水平升高。之前,我们已经证明这一概念在近端小管细胞毒性[27]的机制中是成功的。我们发现ET-通过其内皮素b受体能够上调近端小管中的miRNA133a。通过与多药相关蛋白2 (mrp2)的3'UTR结构域的相互作用,miRNA133a导致该转运体复合体的下调。这一机制在人类疾病如MN和MCN以及小鼠阿霉素模型中均可检测到,其中高尿miRNA133a水平与低mrp-2蛋白水平相关。
为了假设miRNA15a是一种疾病机制的尿生物标志物,我们测试了这个概念是否(i)在近端小管上皮中是正确的;(ii)ET-1作为蛋白介质的治疗保护原则的有用证据。
首先,需要一种可靠的尿生物标记物,这种标记物仅在慢性蛋白尿疾病患者中可检测,但在其他肾脏疾病中不可检测。在蛋白膜性或微小病变肾病中,miRNA15a可通过qRTPCR在高相对荧光单位中轻易检测(图1)相比之下,导致上皮完整性破坏并有望释放其miRNA的急性肾功能衰竭等疾病,尿中miRNA15a的水平并不显著。这应该使miRNA15a成为常规临床实践中的理想标记物。
MiRNA15a也适用,因为它在成人和儿童的同一疾病实体中可检测到(图1)。即使在多次冻融循环后,它在患者尿液中的可靠检测能力也使其非常有用(数据未显示).阿霉素毒性导致蛋白尿的模型是一个合适的研究模型,因为miRNA15a在蛋白尿小鼠的尿液中高度表达(图3B)。
其次,标记物应尽可能针对细胞目标的损伤。激光显微解剖MN或MCD的人类肾活检与新鲜移植肾活检的对照组(所谓的空白活检)表明,miRNA15a在近端小管中最为普遍,在肾小球中的比例较小(图4A)。这一结果在小鼠模型中通过分级筛选得到支持。3周时,肾小管部分含有大部分miRNA15a(图4B)。然而,由于目前在导致miRNA15a上调的NF-κB信号通路中没有已知的单个蛋白质,而miRNA15a上调仅在足细胞或近端小管中对该通路具有特异性,尿液中测定的miRNA15a水平可以从肾单位的不同细胞来源获得,如足细胞和近端小管细胞。
这种miRNA在整个疾病过程中的可检测性很重要,因为在人类疾病中,疾病的确切起始点往往是未知的。在阿霉素肾病中,在长达12周的时间内,可检测到miRNA15a水平升高,主要发生在近端小管中(图4B)。相反,在非蛋白尿人类MCD中,miRNA15a不再可检测(未公布数据)。
第三,由于蛋白尿病患者的尿液中存在不同的介质[5-7,20-23],我们使用不朽的人足细胞、人RPTECs和MDCK细胞进行了细胞培养实验(图2)。在足细胞中MiRNA15a主要通过白蛋白上调(图2A),在近端小管中通过ET-1上调(图2B)。相比之下,其他介质的作用就不显著了。这表明至少在这里面在体外与ET-1相比,补体、转铁蛋白或血管紧张素对miRNA15a激活系统没有任何显著作用。ET-1刺激培养近端小管后的MiRNA15a水平只能与患者的尿液结果相匹配(MN;10 g蛋白尿/d),乘以10倍稀释因子(图2b)。在近端小管中,人血清白蛋白刺激并没有达到与ET-1相当的水平,而白蛋白是永久足细胞的主要介质。
miRNA15a水平之间的差异在体外与体内可能有不同的原因:病理生理机制(免疫vs.非免疫);其他介质;患者中参与miRNA释放的细胞数量高于在体外即使对于近端小管细胞,其他介质对miRNA水平的绝对贡献远小于ET-1,尿液中测得的量也是最大的整个miRNA的收集量从所有可能的来源因此,我们不应期望细胞培养和患者之间存在相似的水平。在人类中,近端小管似乎会释放尿液中生成的大部分miRNA,导致激光显微切割后可检测到少量miRNA。最后,可能怀疑其他细胞参与了尿中miRNA水平,如收集管细胞。然而,当这些细胞在体外可能主要由使用的应用介质刺激(图2C),其临床重要性不确定,因为这是一个跨物种比较(人RPTECs与狗MDCK细胞)。
为了确认miRNA的肾脏来源,我们直接比较了同一蛋白尿患者尿液和血清中的miRNA结果。我们只能在尿液中检测到高水平的miRNA;血液水平至少低了300倍。与同一患者的血清相比,这一结果与来源于近曲小管的透明细胞癌尿液中miRNA15a水平显著升高的情况非常一致[15]。所有这些研究表明,在蛋白尿疾病中,近端小管(肾小球程度较轻)是尿液中miRNA15a的主要来源。
最后,我们测试了miRNA是否是信号通路(PKCα)下调的潜在生物标记物,也可能是成功治疗的指标。在体外应用司来吉兰,神经细胞PKCα水平的上调因子[28],也将ET-1刺激的RPTEC中的miRNA15a水平大幅降低至非刺激的背景值(图3A)。在阿霉素模型中,在3周实验期的最后一周,使用司来吉林治疗后,尿液中高水平的miRNA15a可减少50%(图3B)。因此,即使在疾病过程开始后,这种疗法仍具有良好的耐受性和有效性,其效果可以通过测量尿中的miRNA来检测。由于这种药物已经用于人类治疗[29],单胺氧化酶抑制剂可能提供一种新的治疗方法,在人类蛋白尿疾病中上调PKC水平,以防止ET-1介导的炎症信号级联激活。然而,正如细胞培养实验(图2)所示,miRNA15a并非仅对肾单位沿线的单个细胞类型完全特异,而是来源于足细胞和近端小管细胞,selegeline对这两种细胞类型的miRNA15a的观察效果是该途径对miRNA15a的总体净结果。
慢性蛋白尿的问题在于近端小管上皮-间质转化(EMT)的发展,以及通过增加NF-κB在蛋白尿动物模型中的表达而导致的间质纤维化[30,31]。为了防止这一有害过程,需要使用有效的药物来控制NF-κB的增加,从而减少EMT和间质纤维化。对于第一个要求,我们证明selegiline就是这样一种药物,因为在阿霉素的小鼠蛋白尿模型中,它阻止了负责细胞质转录复合物降解的miRNA15a的成熟,从而增加了NF-κ b的核迁移。因此,尿中miRNA15a水平是成功阻断炎症NF-κB通路的有效指标。
对于第二个要求,必须证明单独或联合阻断NF-κB通路是否足以预防EMT和慢性肾功能衰竭。这需要对不同疾病模型的未来研究,需要延长治疗期,其中治疗和未治疗动物之间的差异可能会变为sible,例如蛋白尿大鼠模型[32]。该治疗概念与肿瘤学中的治疗概念类似,例如,突变受体(如EGFR)导致下游靶点(如酪氨酸激酶抑制)阻断的通路的组成性激活。在我们的案例中,“组成性激活”慢性蛋白尿是炎症途径的重要组成部分,无法充分预防或阻断。选择一个“下游靶点”,即NF-κB,通过司来吉林进行治疗性抑制,可能会预防某种负面结果(即EMT和间质纤维化:待显示),尽管其机制本身(即蛋白尿)正在进行中。
缺乏明显有效的药物来保护近端小管细胞免受蛋白尿条件下释放的介质(如ET-1)的有害影响,部分原因是无法控制应用的药物是否以足够的浓度实际到达近端小管细胞。这可以通过诸如miRNA15a这样的生物标记物来实现,它可以监测这些药物的效果;也就是说,如果信号循环的激活停止了,miRNA15a的水平应该下降或在尿液中不再检测到。
总之,虽然这些实验还需要进一步证实,但我们可以发现,miRNAs(如miRNA15a)确实可以作为诊断和监测蛋白尿条件下近端肾小管细胞中特定通路的治疗效果的生物标记物,特别是当由ET-1介导时。此外,我们的研究也可能鼓励对这一概念的研究,特别是当遗传性疾病,如先天性肾病综合征、原发性FSGS或肿瘤诱导的MN不能克服慢性蛋白尿的基本病理机制时。
资金来源
Heike Loeser是由科隆大学医学院/ Koeln财富计划支持的。梅勒妮·冯·布兰登斯坦拥有科隆大学财富项目博士后奖学金。这项工作得到了玛格和沃尔特·博尔基金会(Marga and Walter Boll Stiftung)的资助。
的利益冲突
没有一个
致谢
通讯作者(J.W.U.F)是这项工作的担保人,因此可以完全访问研究中的所有数据,并对数据的完整性和数据分析的准确性负责。感谢安妮·斯科菲尔德-弗里斯夫人在医学英语方面的帮助。





