摘要
背景:研究MTOR / P70S6K信号通路和早期生长反应的关联(EGR1)调节卵巢切除(OVX)小鼠的认知下降。
方法:使用莫里斯水迷宫(MWM)和电生理学检查,我们评估了OVX-小鼠和假的认知功能的变化。通过定量的实时聚合酶链反应和Western印迹在OVX和假杀蛋白处理之前和之后检测到海马中eGR1,MTOR和P70S6K在海马中的表达。此外,在用EGR1干扰片段或EGR1过度抑制质粒转染后,在SH-SY5Y细胞中监测MTOR和P70S6K的表达。
结果:与假手术组相比,OVX小鼠的逃逸潜伏期显著增加,在靶平台象限的时间缩短,而突触可塑性受损。此外,与假手术组相比,OVX小鼠的海马Egr1、mTOR和p70S6K表达水平明显增加。雷帕霉素治疗后,mTOR/p70S6K和Egr1的表达降低此外,在SH-SY5Y细胞中,Egr1干扰片段或Egr1过表达质粒转染均不会改变mTOR和p70S6K的表达水平。
结论:我们的数据表明,与OVX认知能力下降相关的Egr1表达增加是由mTOR/ p70S6K信号通路调控的。有趣的是,mTOR抑制剂雷帕霉素可降低Egr1水平,可能是绝经后认知功能下降的潜在治疗靶点。
关键字
认知障碍;早期生长反应1;mTOR / p70S6K信号通路;卵巢切除术;雷帕霉素
介绍
轻度认知障碍(MCI)是阿尔茨海默病(AD)的早期临床阶段,其特征是学习和记忆障碍[1,2]。如今,超过20%的80岁以上的人受到AD的影响。流行病学数据预测,到2050年,全球将有3500多万人受到影响[3],这将造成沉重的社会和经济负担。到目前为止,从现有的治疗药物中获得的减缓该疾病进展的益处有限。
绝经期女性,随着雌激素水平的下降,易发生认知障碍[4,5]。雌性啮齿动物卵巢切除术是一种被广泛认可的模拟人类绝经后病理生理变化的模型[6,7]。我们之前的研究结果[8]和其他实验数据[9]表明,去卵巢的啮齿动物中雌激素水平的下降与大脑活动整体下降和记忆力下降有关,特别是海马依赖性学习。研究人员Orawan等报道,去卵巢小鼠不仅血清17-雌二醇水平和子宫重量降低,而且在新物体识别测试中物体识别能力受损,y迷宫和水迷宫测试[11]空间认知能力受损。
早期生长反应1 (Early growth response 1, Egr1)属于锌指转录因子家族[12,13],参与介导生长、增殖、分化和凋亡的多种机制[14-16]。最近的研究表明,Egr1的变化与记忆缺陷的发展有关[17,18]。Gersten等研究发现,Egr1作为海马学习记忆的关键分子,在猴免疫缺陷病毒感染的海马中下调,导致认知[19]缺陷。有趣的是,我们最近的研究表明,去卵巢小鼠中Egr1信使RNA (mRNA)和蛋白水平升高,这与他们的认知障碍[20]有关。
mTOR属于一个特殊的丝氨酸/苏氨酸蛋白激酶家族。mTOR蛋白存在于两个mTOR蛋白复合物mTORC1和mTORC2中,对雷帕霉素[21]的抑制作用有不同的敏感性。p70S6K(丝氨酸/苏氨酸激酶核糖体蛋白)是mTOR活性[22]调控的主要下游靶点之一。近年来,越来越多的研究表明mTOR信号通路与认知缺陷密切相关[23,24]。此外,大量证据表明,在AD患者中发现mTOR信号通路活性升高[25,26]。Caccamo等报道,Tg2576小鼠广泛应用于AD[27]动物模型,抑制mTOR信号通路可以挽救小鼠的记忆缺陷。机制上,mTOR信号的减少可以恢复海马基因表达标记[28]。这些结果提示mTOR信号可能是衰老促进AD发展的分子途径。
有趣的是,Egr1和mTOR/p70S6K信号的异常表达分别与认知缺陷有关。Egr1的过表达是否与mTOR/p70S6K信号通路活性存在潜在联系尚待阐明。因此,在本研究中,我们研究了OVX小鼠mTOR/p70S6K信号通路和认知功能的变化,进一步阐明了Egr1表达与mTOR/p70S6K信号通路之间的潜在关系。通过我们的研究,我们希望在未来的临床实践中为绝经后女性认知障碍的预防和治疗提供线索。
材料和方法
动物和手术
实验开始时体重为25-30g(8-12周)的雌性ICR小鼠(中国江苏省南京医科大学医学动物中心)被用于整个研究。所有动物均在平均(SEM)恒定温度为23℃(±1℃)的标准光/暗循环下饲养。用水合氯醛(500 mg/kg IP)麻醉小鼠(n=50),并随机分为两组,采用无菌外科技术通过腹侧途径进行双侧卵巢切除(n=25)或假手术(n=25)。目视检查证实卵巢完全切除。在所有手术前后,五只老鼠被安置在一个塑料吊笼中,并允许自由获取食物和自来水。这项研究得到了南京医科大学第一附属医院动物与人类伦理委员会的批准。所有的努力都是为了尽量减少动物的痛苦和减少使用动物的数量。
莫里斯水迷宫试验
莫里斯水迷宫(MWM)该试验旨在测试小鼠的学习和记忆能力。试验分为四个象限:东南部、西南部、东北部和西北部,在固定位置放置一个10 cm的黑色圆形逃生平台,位于水面下方约2 cm处。暴露在25°C室温下,水是不透明的,水池涂有黑色n在有毒的天妇罗涂料上。连续5天训练小鼠寻找隐藏的平台,每天进行4次训练试验。如果小鼠在60秒内到达平台,则允许其在平台上停留10秒;否则,将其轻轻引导至平台,并在平台上停留10秒。到达平台所需的时间(逃逸潜伏期)在探测器测试期间,视频跟踪系统记录了在目标象限内的时间。
药品监督管理局
通过立体定位器进行侧脑室注射。小鼠用2%水合氯醛(20 ml/kg)麻醉,置于立体定向装置(Kopf Instruments, Tujunga, CA)中。通过注入油墨进行了初步实验,确定了注入部位。在右侧脑室(后侧0.3 mm,外侧1.0 mm,与bregma腹侧2.5 mm)植入26号单导导管(Plastics One, Roanoke, VA)。术后,在每个导管中插入一个28号假导管(Plastics One, Roanoke, VA)。无论是针头的插入还是生理盐水的注射都对生存、行为反应或认知功能没有显著影响。
雷帕霉素溶解于二甲基亚砜(DMSO, Sigma, St Louis, MO, USA)中,然后溶解于盐溶液中,最终浓度为20 mg/kg。DMSO的最终浓度为2%作为车辆控制。用步进电动微注射器(Stoelting, Wood Dale, IL, USA)以0.5 ml/min的速度注射药物(最终体积0.6µl/小鼠)。雷帕霉素(1.0 mg/kg)或等体积对照药在疗程2分钟内逐渐给予。
细胞培养与治疗
SH-SY5Y神经母细胞瘤细胞系(ATCC,中国上海)是许多研究中阐明阿尔茨海默病分子机制非常流行的细胞模型[29,30]。SH-SY5Y细胞在添加了10%热灭活胎牛血清的Dulbecco改良Eagle培养基/F12(中国杭州天杭)中,在37℃、含5% CO2的湿化气氛中培养。为了研究Egr1与mTOR/p70S6K信号通路的关系,我们利用Lipofectamine 3000(美国Invitrogen公司,Carlsbad, CA)将eggr1过表达质粒(GV141- Egr1质粒)、GV141-Egr1对照(vector)、Egr1 siRNA和si-Egr1对照(si-Egr1 NC) (Genechem, Shanghai, China)转染SH-SY5Y细胞。并将mTOR抑制剂雷帕霉素(4µM)应用于细胞,进一步验证结果。转染或雷帕霉素处理48小时后,收集细胞进行总RNA分离或蛋白纯化。
RNA提取和定量实时PCR
根据制造商的说明,使用基于trizol的商业试剂盒(Takara Shuzo Co. Ltd, Kyoto, Japan)对新鲜海马组织进行均质和总RNA的分离。每个RNA样品的纯度由在260和280 nm处的吸光度比测定。用含有0.005%核酸染料的1.2% (w/v)琼脂糖凝胶(Goldview, Shanghai SaiBaiSheng, Shanghai, China)对RNA制剂的完整性进行电泳评价。提取的RNA含核糖体28S和18S RNA,吸光度比为1.0 ~ 1.5,进行qRT-PCR。在实时PCR反应中,以cdna为模板扩增,使用quantitative SYBR Green PCR试剂盒(Takara Shuzo Co Ltd, Kyoto, Japan)定量靶基因的mRNA水平。甘油醛-3-磷酸脱氢酶(GAPDH)或U6作为样品上样和标准化的内对照。比较Ct(阈值循环)方法与算术公式(2——ΔΔCt)用于确定mRNA的相对量。
免疫印迹分析
在含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液中均化总蛋白质样品。使用BCA蛋白质测定试剂盒(KC-430; Kang Chen)定量来自所有提取的蛋白质。将蛋白质样品用8%十二烷基乙二烷基水丙烯酰胺凝胶电泳分离,并转移到聚偏二氟化乙烯膜(Millipore,Billerica,MA)中。将膜在三缓冲盐水+ 1%Tween 20(TBST)中在37℃下封闭5%非牛奶或5%牛血清白蛋白。然后将膜与适当的一抗:兔抗磷粉(P-MTOR)抗体(1:1000,AB109268; ABCAM,伦敦,英国),兔抗MTOR抗体(1:1000,AB87540; ABCAM),兔抗磷酸-P70S6K(P-P70S6K)抗体(1:1000,AB109393; ABCAM),兔抗P70S6K抗体(1:1000,AB32359; ABCAM),兔抗EGR1抗体(1:5000,AB194357; ABCAM)和兔抗微管蛋白抗体(1:5000,AB176560; ABCAM)在4℃下过夜。在37℃下用TBST洗涤10分钟后,将膜与辣根过氧化物酶 - 缀合的二抗(北京中山,北京,中国)孵育1小时,孵育3小时。使用ECL检测试剂盒(Amercontrol Biosciences,UK)检测频段。
免疫荧光和共焦成像
评价细胞内的表达水平egr1 mTOR用免疫荧光共焦显微镜,SH-SY5Y细胞培养在poly-d-lysine涂镀在盖玻片盖玻片24 h。细胞被固定在4%多聚甲醛在磷酸盐(PBS) 20分钟,在PBS洗一次,0.1% Triton X-100可渗透,1% BSA、50 mM甘氨酸和2%正常血清可阻断。选用抗以下蛋白的一抗:兔抗mtor抗体(1:100)、兔抗egr1抗体(1:100),4℃过夜。第二天,用PBS冲洗盖片,然后用FITC(异硫氰酸荧光素)标记的二抗孵育,室温下应用1小时。为了对细胞核进行染色,加入1 μg/ml(w/v) 4 ', 6-二氨基-2-苯基吲哚(DAPI, Sigma, USA) 5分钟。在Olympus Fluoview 1000激光扫描共聚焦显微镜上,使用20倍和40倍物镜,数值孔径为1.42,获得共聚焦免疫荧光图像(1024×1024像素)。
电生理分析
大脑被迅速取出并放入由124NaCl,2CaCl(单位:mM)组成的冰冷含氧人工脑脊液(ACSF)中2, 4.5KCl, 1.0 MgCl2,26号3.1.2不2PO4和10D葡萄糖,并通过与95%O鼓泡调节至pH7.42/5%公司2混合物。使用振动切片机(Microslicer DTK 1500, DTK 1500, Dousaka EM Co, Kyoto, Japan)在冰冷的氧合(95% O2/ 5%CO2)ACSF。
为了记录,切片被转移到持续灌注氧合ACSF (2ml/min)保持在30˚C的室中。通过连接Axoclamp2B放大器(Axon Instruments, Foster City, CA, USA)的充满2 M NaCl (4-5 MΩ)的玻璃微管从BLA记录刺激诱发群体峰(PS)。PS反应采用pCLAMP软件(Axon Instruments, Foster City, CA, USA)采样。输入-输出(I/O)曲线是通过绘制兴奋性突触后电位(EPSP)斜率对0.1 mA到1.1 mA的刺激强度,从阈下强度激发PS到激发最大响应。为了诱导长期变化,在100 Hz下给予刺激强度为最大刺激强度50%的单列高频刺激(HFS),持续1 s。为了评估长期增强(LTP),与hfs前hfs后持续60分钟的记录相同,数据以hfs前hfs平均值的百分比表示。成功的LTP诱导需要在稳定阶段(>在hfs后30分钟)PS振幅增加至少20%。
统计分析
数据以均数±标准差表示,结果采用SPSS统计软件包20.0 (SPSS Inc., Chicago, IL, USA)的单因素方差分析和Scheffe '多范围检验进行分析。采用单因素方差分析(one-way ANOVA test)评估组间差异,采用Scheffe ' multiple-range test比较两组间差异。P<0.05为差异有统计学意义。
结果
去卵巢12周小鼠认知行为的变化
在培训期间,所有小鼠都花费更少的时间逐天找到隐藏的平台,但是12周龄OVX小鼠比训练试验的最后一天的年龄匹配的假手术小鼠显着显着显示出较长的逃避延迟(P <0.05,n = 25;图1a)。与假小鼠相比,12周龄OVX小鼠在象限中花了更少的时间,即在之前的隐藏平台(P <0.01;图1B)。如图1c所示,假手术小鼠中的探索性状典型游泳模式的特征在于靶象限明显更长的距离,而代表平台交叉的同心游泳路径被发现在OVX小鼠中。
OVX对海马LTP诱导的影响
为了探讨卵巢切除术对神经元的影响,我们研究了穿支通路-颗粒细胞突触的电生理变化。如图1D所示,在0.1-1.1 mA的刺激下,去卵巢12周小鼠的EPSP斜率始终小于年龄匹配的Sham小鼠(P<0.05;n = 6)。HFS可诱导Sham小鼠海马穿通路-颗粒细胞突触EPSP显著增加,持续时间至少为60分钟(简称LTP)。然而,类似的HFS不能导致去卵巢小鼠LTP诱导(图1E)。
eGR1和MTOR途径在小鼠海马中的表达
与Sham组相比,OVX小鼠12周龄海马区Egr1 mRNA和Egr1蛋白表达水平显著升高(P<0.01;图2 c)。值得注意的是,我们发现在OVX小鼠中mTOR/p70S6K信号通路的mRNA水平也上调。如图2A和2B所示,卵巢切除后12周海马区mTOR和p70S6K mRNA的表达分别比sham小鼠高1.45倍和1.38倍(P<0.05)。此外,我们的结果提示,OVX小鼠中不仅mTOR和p70S6K总蛋白上调,phospho-mTOR Ser2448和phospho-p70S6K Ser371蛋白也显著高于Sham小鼠(P<0.05;图2 g)。
为探讨Egr1与mTOR信号通路的关系,MWM试验后的OVX小鼠经脑室注射mTOR抑制剂雷帕霉素(1.0 mg/kg)治疗一周。与对照相比,雷帕霉素负调控Egr1 mRNA表达(P<0.01;图2F)、mTOR信号通路(P<0.01;图2D和2E)。蛋白变化与mRNA分析结果一致(P<0.05;图2 h)。
SH-SY5Y细胞中Egr1表达与mTOR信号通路的关系
通过免疫荧光和共聚焦显微镜,评估了Egr1和mTOR在SH-SY5Y细胞中的亚细胞定位。Egr1的亚细胞定位主要在核周细胞质和细胞核中(图3A),而mTOR主要在核周细胞质中观察到(图3B)接下来,我们用siEgr1片段或Egr1过表达质粒转染细胞,以探讨Egr1对mTOR/p70S6K表达的影响。在转染Egr1过表达质粒或si-Egr1片段48小时后,SH-SY5Y细胞中mTOR和p70S6K的表达与对照组相比没有变化,包括mRNA和p70S6K的表达ein水平(P>0.05;图4A-4H)。为了进一步证实Egr1和mTOR/p70S6K之间的关联,最终用雷帕霉素(4µM)处理细胞48小时。与OVX小鼠海马中的上述结果一致,雷帕霉素处理负性调节Egr1 mRNA表达(P<0.01;图5C),以及mTOR/p70S6K信号通路(P<0.01,P<0.05;图5A和5B)。雷帕霉素治疗后蛋白质水平也有类似结果(P<0.05;图5D)。
讨论
在这项研究中,我们通过MWM试验证实,12周时卵巢切除可能会损害小鼠的学习和记忆,包括逃逸潜伏期增加,在目标平台象限的时间缩短,这与我们之前的结果类似[31]。此外,我们发现OVX和假手术小鼠的电生理检查存在显著差异,卵巢切除小鼠的EPSP斜率始终小于假手术小鼠,并且在OVX中出现LTP诱导缺陷。通常,EPSP斜率和LTP诱导用于评估神经元的突触可塑性,这与认知功能密切相关[32,33]。根据许多研究,雌激素可显著增加海马树突棘和突触密度,其认知保护功能近年来已被充分发现[34,35]。因此,在我们的研究中,卵巢切除后12周小鼠雌激素缺乏可能会损害突触可塑性,最终导致认知能力下降。这些结果得到了其他一些关于降低哺乳动物模型雌激素水平后电生理变化的研究的支持[36,37]。

图1:卵巢切除术后12周认知功能的变化
一个:比较去卵巢(OVX)和假手术(sham)小鼠在其他三个非靶象限中寻找平台的逃避潜伏期。B:每组在Morris水迷宫(MWM)训练5天的探针试验中在目标象限游泳的时间。C:每组在MWM第6天探针测试的代表性路径轨迹。D:输入输出(I/O)曲线。通过0.1 ~ 1.1 mA的穿孔通路刺激诱发EPSP斜率。每个点代表EPSP斜率的组均值(SEM)。E: 100hz - cs诱导后OVX和Sham小鼠切片中通路-颗粒细胞突触传递的变化。* * * P < 0.05, P < 0.01。
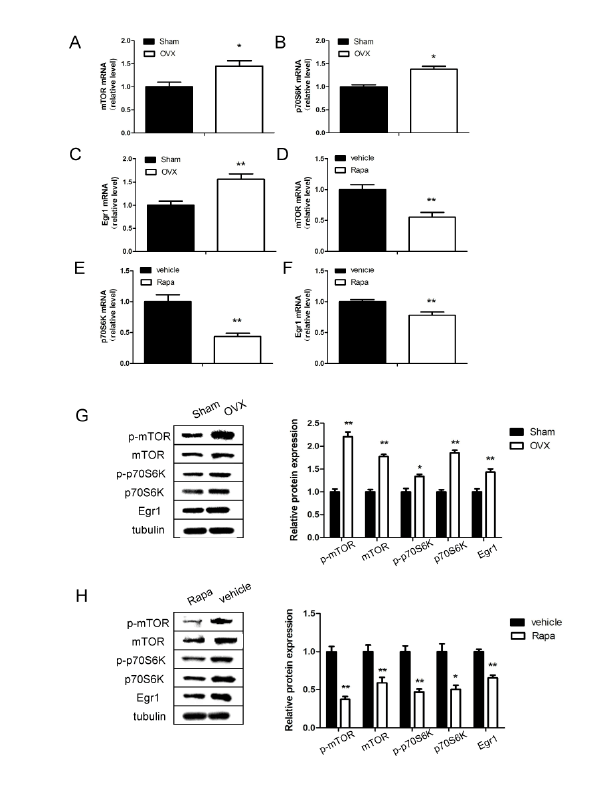
图2:Egr1、mTOR和p70S6K在去卵巢和假手术小鼠海马组织中的表达
定量逆转录聚合酶链反应分析MTOR的信使RNA水平(一个和D),p70S6K(B和E)及Egr1 (C和F)分别在去卵巢和雷帕霉素治疗的小鼠中。G:卵巢切除术后12周Egr1、mTOR、p70S6K蛋白水平的Western blot分析。H:雷帕霉素治疗一周后Egr1、mTOR、p70S6K的相对蛋白水平。* * * P < 0.05, P < 0.01。

图3:共聚焦免疫荧光显微镜观察SH-SY5Y细胞中Egr1和mTOR的亚细胞定位。
A: Egr1蛋白亚细胞定位。B: mTOR蛋白亚细胞定位。将细胞接种到覆膜上,分别用Egr1和mTOR抗体染色,然后用FITC(绿色)标记二抗。细胞核用4 ',6-二氨基-2-苯基吲哚(DAPI,蓝色)显示。
Egr1被认为是与海马相关的学习和记忆的参与者。它在LTP的维持和形成以及成年神经发生中起着至关重要的作用,表现为它在齿状回新生神经元[38]的选择、成熟和功能整合中的作用。与我们之前的报道类似,在我们最近的研究中,在卵巢切除术后12周,海马区检测到了Egr1的过表达。然而,由于也有报道显示Egr1在猿海马中下调,导致认知[19]缺陷,因此需要进一步研究不同物种和细胞中Egr1的表达,以阐明这些差异。有趣的是,我们本研究还发现,小鼠在卵巢切除术后12周出现认知缺陷时,海马区mTOR、phospho-mTOR及其下游靶蛋白p70S6K和phospho-p70S6K水平升高,与部分文献收集的研究结果一致[39,40]。
在过去十年中,在AD模型中广泛报道了mTOR信号,这表明mTOR信号通路的异常上调可能与神经退行性过程的发展有关[41,42].为了探索Egr1和mTOR信号通路在OVX小鼠认知障碍中的关系,用mTOR抑制剂雷帕霉素治疗OVX小鼠。与溶媒对照相比,雷帕霉素治疗对Egr1 mRNA和蛋白表达产生负性调节,与其他一些研究一致[43,44]。
最后,我们在SH-SY5Y细胞中执行并验证了Egr1基因与mTOR信号通路之间的关系。在SH-SY5Y细胞中,Egr1和mTOR的亚细胞定位同时存在。转染si-Egr1片段和Egr1过表达质粒后,mTOR和p70S6K mRNA和蛋白表达均无变化。与上述结果一致,在OVX小鼠海马中,雷帕霉素处理负调控了Egr1 mRNA和蛋白的表达,以及mTOR/p70S6K信号通路。

图4:转染Egr1过表达质粒或si-Egr1片段后SH-SY5Y细胞中Egr1、mTOR和p70S6K的表达分别用si-Egr1对照(si-Egr1 NC)、si-Egr1片段(si-Egr1)、GV141-Egr1对照(载体)、GV141-Egr1 (GV141- Egr1)转染细胞。转染过表达Egr1质粒或si-Egr1片段后SH-SY5Y细胞中Egr1 (A和D)、mTOR(B和E)和p70S6K(C和F)信使RNA水平的变化。G、H:转染后Egr1、mTOR、p70S6K的相对蛋白水平。* * * P < 0.05, P < 0.01。

图5:雷帕霉素治疗后SH-SY5Y细胞EGR1,MTOR和P70S6K的表达(4μm)。MTOR(A),P70S6K(B)和EGR1(C)在雷帕霉素处理后SH-SY5Y细胞中的信使RNA水平48小时。D:用雷帕霉素治疗48小时后EGR1,MTOR和P70S6K的相对蛋白质水平。* * * P < 0.05, P < 0.01。
综上所述,我们的结果表明Egr1和mTOR/p70S6K的过度表达有助于OVX小鼠的认知能力下降,并且Egr1可由mTOR/p70S6K信号调节在活的有机体内和体外研究。Egr1可能是认知功能下降发病机制中mTOR/p70S6K信号通路的下游调控因子。这一结论与最新研究相似,表明Egr1的表达可以被mTOR[45]的经典下游调控因子4EBP1调控。然而,对于OVX模型中mTOR/p70S6K/ Egr1和认知障碍的分子机制还需要进一步的研究。
到目前为止,对绝经后女性的认知障碍/AD还没有有效的治疗方法或常规药物。认知缺陷的信号网络是复杂的,有许多下游的生理输出,因此其与年龄相关的作用机制尚未完全阐明。据我们所知,本研究首次证明mTOR/p70S6K/ Egr1信号通路参与认知功能障碍的发生发展,可能在该疾病的发病机制中发挥重要作用,并可能成为绝经后衰退临床实践的潜在靶点。
结论
综上所述,我们的数据表明,在OVX小鼠中,Egr1和mTOR/p70S6K的过表达导致了认知能力的下降,在体内和体外研究中,Egr1可以被mTOR/p70S6K信号通路调节。我们目前的研究结果表明mTOR/p70S6K/ Egr1信号通路参与了认知功能障碍的发病机制。我们的发现可以在临床实践中为绝经后衰退的发展和进展提供一种新的机制。
相互竞争的利益
作者声明他们没有利益冲突。
作者的贡献
SZ:实验表现,数据收集,手稿撰写,JC:实验表现,数据分析,WZ:数据分析,JW:项目开发,手稿编辑。
认定和资金
非常感谢南京医科大学生理学系的陈玲为我们提供电生理检查的技术支持。本研究由国家自然科学基金资助项目(No. 81170540);江苏省科委自然科学基金资助项目(No. 81170540);江苏省神经退行性变重点实验室资助项目(No SJ11KF06);






